概述
卡培他滨的推荐剂量是在一项开放标签、随机临床研究中确定的,旨在探索卡培他滨连续治疗(1331 mg/m2/天,分两次服用,n=39)、卡培他滨间歇治疗(2510 mg/m2/天,分两次服用,n=34),以及卡培他滨联合口服亚叶酸(LV)的间歇治疗(卡培他滨 1657 mg/m2/天,分两次服用,n=35;亚叶酸60mg/天)在一线转移环境中的晚期和/或转移性结直肠癌患者中的疗效。卡培他滨中加入亚叶酸的反应率没有明显优势;然而,毒性却增加了。卡培他滨,1250mg/m2,每天两次,持续14天,然后休息1周,根据所研究的三个方案的总体安全性和有效性概况被选择用于进一步的临床开发。
单药治疗
来自两项涉及1207名患者的开放标签、多中心、随机、对照临床试验的数据支持在转移性结直肠癌患者的一线治疗中使用卡培他滨。这两项临床研究在设计上完全相同,在不同国家的120个中心进行。研究1在美国、加拿大、墨西哥和巴西进行;研究2在欧洲、以色列、澳大利亚、新西兰和台湾进行。
总之,在这两项试验中,603名患者被随机分为两组,每天两次,每次1250 mg/m2,连续两周,然后休息1周,并以3周为周期给予卡培他滨治疗;604名患者随机接受5-氟尿嘧啶和亚叶酸治疗(静脉注射20 mg/m2亚叶酸,然后每28天静脉注射425 mg/m2 5-氟尿嘧啶)。
在这两项试验中,对总生存期、进展时间和缓解率(完全和部分缓解)进行了评估。根据世界卫生组织的标准确定答案,并提交给盲法独立审查委员会(IRC)。
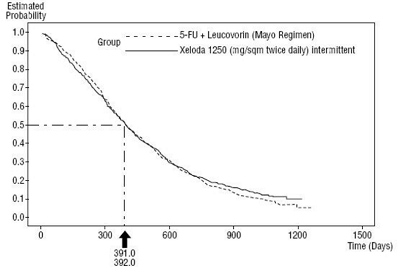
在试验1中,卡培他滨组的中位无进展生存期(128天)与5-氟尿嘧啶和亚叶酸组的无进展生存(131天)无显著差别;卡培他滨组的总生存期380天,5-氟尿嘧啶和亚叶酸的总生存期为407天。在试验2中,卡培他滨组的中位无进展生存期(137天)与5-氟尿嘧啶和亚叶酸组的无进展生存(131天)无显著差别;卡培他滨组的总生存期404天比5-氟尿嘧啶和亚叶酸的总生存期(369天)高出33天。
汇总数据总生存率的Kaplan-Meier曲线(研究1和研究2)

- 【非小细胞肺癌】SH-1028片[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- 【食管鳞癌】LY01015注射液联合氟尿嘧啶和顺铂[适 应 症]晚期或转移性食管鳞癌[试验分期]Ⅲ期
- 【黑色素瘤】GT101注射液[适 应 症]一线治疗失败的宫颈鳞癌或恶性黑色素瘤患者[试验分期]Ⅰ期
- 【实体瘤】注射用TFX05-01[适 应 症]本品拟用于经病理组织/细胞学或临床诊断确诊,不适合手术或局部治疗, 或经过手术和/或经末线标准治疗后疾病进展和/或无法耐受标准治疗的晚期恶性实体瘤患者。[试验分期]Ⅰ期
- 【实体瘤】BC007抗体注射液[适 应 症]CLDN18.2表达的晚期实体瘤[试验分期]Ⅰ期
- 【淋巴瘤】MIL62注射液联合来那度胺胶囊[适 应 症]难治的滤泡性淋巴瘤[试验分期]Ⅲ期