概述
卡培他滨与多西紫杉醇联合应用和单药治疗已在临床试验中得到评估。
联合多西紫杉醇
在第3阶段临床试验中,卡培他滨与多西紫杉醇联合使用的剂量基于第1阶段研究的结果,在该阶段研究中,评估了以3周为周期给予的多西紫杉醇与卡培他滨间歇方案(治疗14天,然后休息7天)的剂量范围。根据多西他赛3周周期75mg/m2与1250mg/m2联合用药的耐受性选择联合用药方案,每天两次,为期14天,卡培他滨3周为一个周期。
卡培他滨联合多西紫杉醇全球75个中心进行了开放标签、多中心、随机试验。共有511名转移性乳腺癌患者被纳入研究,这些患者对蒽环类药物治疗耐药,或在蒽环类药物治疗期间或之后复发,或在完成蒽环类药物辅助治疗后2年内复发。255名患者随机接受卡培他滨1250 mg/m2每日两次,持续14天,随后1周不治疗,多西紫杉醇75 mg/m2静脉滴注1小时,3周为一个周期。在单药治疗组中,256名患者接受了多西他赛100 mg/m2的静脉滴注,为期3周。
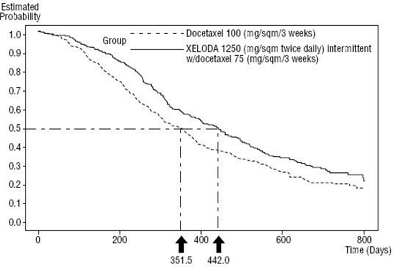
试验结果表明,卡培他滨与多西紫杉醇联合的中位无进展生存期(mPFS)为186天,比单用多西紫杉醇多出62天;联合治疗的中位总生存期(mOS)为442天,单药治疗的总生存期为352天。总的来说,与单用多西紫杉醇治疗相比,卡培他滨与多西紫杉醇联合治疗在疾病进展时间、总生存率和客观缓解率方面有统计学显著改善。如图1和图2所示。
图1:卡培他滨和多西紫杉醇与多西紫杉醇的疾病进展时间的 Kaplan-Meier分析曲线
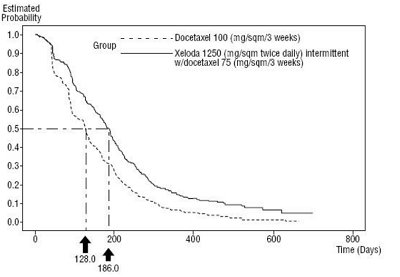
图2:卡培他滨和多西紫杉醇与多西紫杉醇存活率的Kaplan-Meier分析曲线
单药治疗
卡培他滨作为单一疗法的抗肿瘤活性在美国和加拿大的24个中心进行的开放标签单臂试验中进行了评估。共有162名IV期乳腺癌患者入选。主要终点是可测量疾病患者的肿瘤反应率,反应定义为至少大于一个月。卡培他滨的剂量为1255mg/m2,每天两次,持续2周,然后休息1周,以3周为一个周期。耐药性被定义为在接受治疗期间进行性疾病,有或没有初始反应,或在使用含蒽环类药物的辅助化疗方案完成治疗后6个月内复发。
对于43名双重耐药的亚组患者,中位进展时间为102天,中位生存期为255天。该人群的客观缓解率由135名可测量疾病患者的缓解率18.5%(1 CR,24 PRs)支持,这些患者对化疗的耐药性较低。中位进展时间为90天,中位生存期为306天。

- 【非小细胞肺癌】SH-1028片[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- 【食管鳞癌】LY01015注射液联合氟尿嘧啶和顺铂[适 应 症]晚期或转移性食管鳞癌[试验分期]Ⅲ期
- 【黑色素瘤】GT101注射液[适 应 症]一线治疗失败的宫颈鳞癌或恶性黑色素瘤患者[试验分期]Ⅰ期
- 【实体瘤】注射用TFX05-01[适 应 症]本品拟用于经病理组织/细胞学或临床诊断确诊,不适合手术或局部治疗, 或经过手术和/或经末线标准治疗后疾病进展和/或无法耐受标准治疗的晚期恶性实体瘤患者。[试验分期]Ⅰ期
- 【实体瘤】BC007抗体注射液[适 应 症]CLDN18.2表达的晚期实体瘤[试验分期]Ⅰ期
- 【淋巴瘤】MIL62注射液联合来那度胺胶囊[适 应 症]难治的滤泡性淋巴瘤[试验分期]Ⅲ期