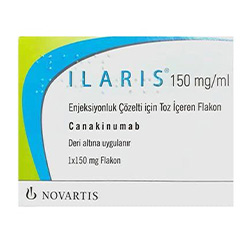
Canakinumab目前未在国内上市。Canakinumab(卡那单抗)是一种免疫球蛋白G1/κ同种型的人单克隆抗体,可通过阻断IL-1β与细胞膜表面的1型IL-1受体及白介素受体协同蛋白结合,阻断炎症反应通路,从而降低体内的炎症反应水平。
canakinumab在中国上市了吗?
早在2009年,canakinumab就已经获批用于cryopyrin相关性周期综合征和家族性冷自身炎症综合征的治疗。2013年,canakinumab获批用于2岁或以上全身型幼年特发性关节炎患者的治疗。遗憾的是,canakinumab并未在中国上市。
1.监管审批
中国的药物监管机构可能要求制药公司提供符合中国法规标准的审批文件。这可能涉及到额外的临床试验或数据,以确保药物在中国患者中的安全性和有效性。
2.市场策略
制药公司可能基于市场分析、竞争状况以及患者需求等因素,决定是否在特定地区上市某种药物。
3.经济因素
药品的价格和成本也可能影响一种药物是否在某个国家上市。有时,制药公司可能需要与当地医疗体系和保险公司谈判价格,以确保药物的可及性。
若您对canakinumab在中国的最新上市情况感兴趣,建议查阅中国国家药品监督管理局(NMPA)的官方公告,或者向相关的医疗专业人员咨询。在使用canakinumab时,一些重要的注意事项也要牢记。
canakinumab使用时应注意什么?
以下注意事项对于使用canakinumab治疗特定疾病的患者和医生来说非常重要。
1.严重感染
canakinumab与严重感染的风险增加相关。对于那些有感染史、复发性感染或患有易感染的基础疾病的患者,应该谨慎使用canakinumab。在患者出现活动性感染且需要医疗干预的情况下,应该避免给予canakinumab。
2.过敏反应
在canakinumab的治疗中曾报告有过敏反应。已知对canakinumab具有临床过敏反应的患者不应该继续接受治疗。如果发生严重的过敏反应,应该立即停止使用canakinumab,并进行适当的治疗。想了解更多canakinumab的相关信息吗?点击免费在线咨询
【药队长温馨提示】在使用canakinumab的治疗过程中,患者和医生应该密切合作,定期进行监测和评估,以确保治疗的安全性和有效性。

- 【系统性红斑狼疮】C-CAR168细胞回输注射液[适 应 症]系统性红斑狼疮[试验分期]Ⅱ期
- 【系统性红斑狼疮】F01注射液[适 应 症]系统性红斑狼疮[试验分期]Ⅰ期
- 【系统性红斑狼疮】anti-CD19-CAR-T细胞注射液[适 应 症]系统性红斑狼疮[试验分期]Ⅰ期
- 【系统性红斑狼疮】LCAR-AIO[适 应 症]系统性红斑狼疮[试验分期]Ⅰ期
- 【强直性脊柱炎】SCT650C 注射液[适 应 症]强直性脊柱炎[试验分期]Ⅱ期
- 【银屑病】HB0017注射液[适 应 症]银屑病[试验分期]Ⅱ期