Ezharmia的注意事项
Ezharmia治疗开始前,应向患者或其家属充分说明有效性和危险性,征得同意后方可开始给药。在能够充分应对紧急情况的医疗设施中,在对造血器官恶性肿瘤的治疗有充分知识、经验的医生的指导下,仅针对认为适合使用本药的患者进行Ezharmia给药。
对本剂成分有过敏症病史的患者禁用Ezharmia。
Ezharmia可出现骨髓抑制,开始给药前及给药过程中应定期血常规,充分观察患者情况。
为了避免饮食的影响,应避免在饭前一小时到饭后两小时之间服用Ezharmia。
指导患者在给药过程中和给药后一定时间内进行合理避孕。
Ezharmia治疗期间不建议哺乳。
没有实施以儿童等为对象的临床试验。
Ezharmia日本第一三共
Ezharmia片剂具有吸湿性,应在服用前指导其从PTP中取出。由于误食PTP片,硬的尖角部会刺入食道粘膜,进而引起穿孔,有时会并发纵膈窦炎等严重的并发症。指导PTP包装的药剂从PTP中取出服用。
临床试验中有报道表现为继发恶性肿瘤,如慢性粒细胞白血病、慢性白血病。
若因服用本品而出现不良反应,应参考以下标准,停药、减量或中止本品。 另外,同一副作用引起的减重最多为2个阶段。Ezharmia常规剂量,200毫克;一级减量150毫克;两阶段减量,100毫克;三级减量,50毫克;四阶段减量,停止给药。
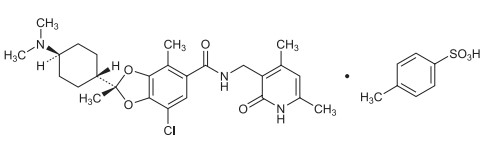
Ezharmia是由日本第一三共(Daiichi Sankyo)制药研发的,于2022年9月26日获得日本厚生劳动省(MHLW)批准上市,用于治疗复发或难治性成人 T 细胞白血病/淋巴瘤 (ATL),是全球第一个获得监管批准的EZH1/EZH2双重抑制剂。Ezharmia旨在通过靶向EZH1和EZH2对抗表观遗传失调,不仅治疗效果显著,而且安全性良好,最常见的包括血小板计数减少、贫血、味觉障碍(味觉障碍)和白细胞计数减少。更多关于Ezharmia的详情可以阅读药物说明书,建议患者遵医嘱用药,对症治疗。
- 【非小细胞肺癌】SH-1028片[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- 【食管鳞癌】LY01015注射液联合氟尿嘧啶和顺铂[适 应 症]晚期或转移性食管鳞癌[试验分期]Ⅲ期
- 【黑色素瘤】GT101注射液[适 应 症]一线治疗失败的宫颈鳞癌或恶性黑色素瘤患者[试验分期]Ⅰ期
- 【实体瘤】注射用TFX05-01[适 应 症]本品拟用于经病理组织/细胞学或临床诊断确诊,不适合手术或局部治疗, 或经过手术和/或经末线标准治疗后疾病进展和/或无法耐受标准治疗的晚期恶性实体瘤患者。[试验分期]Ⅰ期
- 【实体瘤】BC007抗体注射液[适 应 症]CLDN18.2表达的晚期实体瘤[试验分期]Ⅰ期
- 【白血病】苯磺酸克立福替尼片[适 应 症]复发或难治的携带FLT3-ITD突变的急性髓性白血病[试验分期]Ⅲ期