罕见致癌性驱动基因—RET融合与肺癌脑转移密切相关
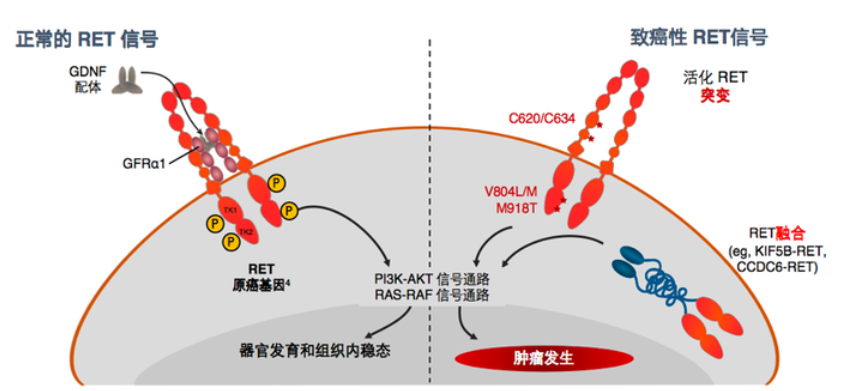
转染重排(RET)融合是多种实体瘤的罕见致癌性驱动基因,在非小细胞肺癌中的发生率不足2%。但在无吸烟史RET融合阳性的非小细胞肺癌年轻患者中,确诊时脑转移的发生率约为17.7-27.8%。
RET融合信号传导通路示意图(图源于网络 侵权请告知)
化疗和免疫治疗用于RET融合阳性实体瘤的临床疗效有限,赛普替尼(Selpercatinib、塞尔帕替尼)作为RET选择性酪氨酸激酶抑制剂(TKI),在RET融合阳性的非小细胞肺癌和甲状腺癌患者中显示出良好的疗效,已成为此类患者的首选一线用药。
赛普替尼获批,成为国内首款RET靶向新药
2020年5月赛普替尼首次获美国药监局(FDA)批准上市,现已有多项适应症获批。该药还是首款踏入国内市场的RET靶向新药,赛普替尼可通过抑制RET/SHC/ERK1/ERK2蛋白磷酸化,阻碍MAPK信号通路的传导,减缓肿瘤细胞的增殖速度,发挥抗肿瘤作用。
赛普替尼挑战脑转移RET融合阳性肺癌,颅内疗效持久且稳健
既往研究中发现,赛普替尼具有显著的中枢神经系统(CNS)活性,因此研究人员在LIBRETTO-001试验中,评估了赛普替尼用于RET融合阳性非小细胞肺癌患者的颅内疗效。
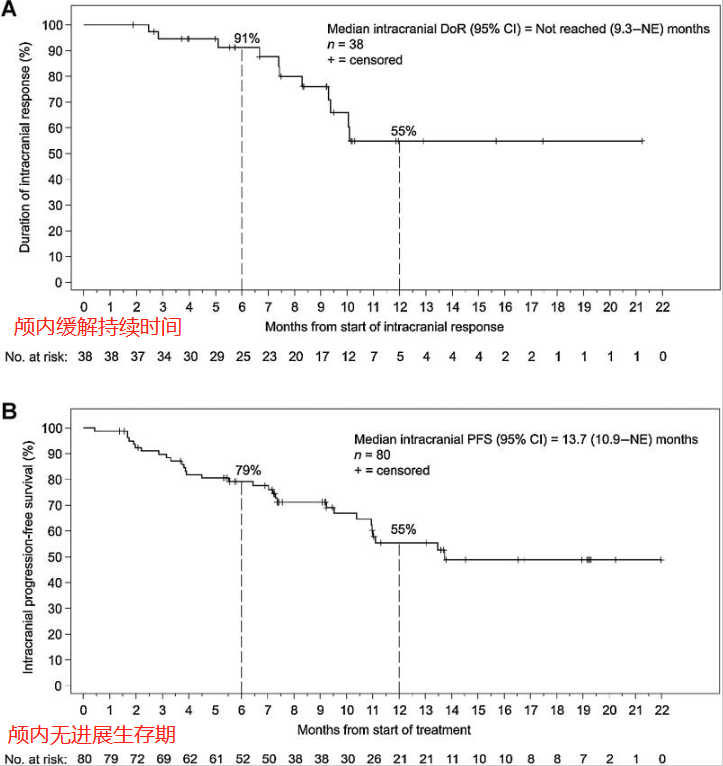
入组该试验的全部患者中有80例出现脑转移,其中位颅内无进展生存期(PFS)为13.7个月。研究发现,其中22例基线时患有可测量颅内疾病的RET融合阳性非小细胞肺癌患者,接受赛普替尼治疗后颅内客观缓解率(ORR)高达82%,其中23%实现颅内完全缓解(CR)。中位随访9.5个月后,未达到中位颅内缓解持续时间(DOR),并且赛普替尼治疗一年时,55%的患者颅内缓解仍在持续。
LIBRETTO-001试验的疗效结果示意图(图源于网络 侵权请告知)
安全性上,与入组LIBRETTO-001试验的总体人群相比,出现脑转移的患者未发现新的不良反应。该试验证实,赛普替尼对于已出现脑转移的RET融合阳性非小细胞肺癌患者,具有持久且稳健的颅内疗效。
重磅!赛普替尼用于经多线治疗的中国患者疾病控制率达97%
在ARROW I/I研究的中国亚组分析显示,经铂类治疗失败后的RET融合阳性非小细胞肺癌中国患者接受赛普替尼治疗,客观缓解率为56%,疾病控制率(DCR)甚至高达97%,这些患者中有一半至少接受过≥3线系统治疗。该亚组分析结果一经发布震惊国内,这意味着赛普替尼或将为经多线治疗的RET融合阳性非小细胞肺癌中国患者带来新的治疗选择。
泛癌种明星靶点药物—赛普替尼,获批用于多种实体瘤
2022年9月,赛普替尼再次传来喜讯,FDA加速批准其用于既往接受过全身治疗且在治疗期间或治疗后发生进展,或尚无令人满意的替代治疗选择的RET融合阳性局晚期或转移性实体瘤成人患者。这使得赛普替尼的适应症进一步扩大,成为备受瞩目的泛癌种明星靶点药物。目前除了肺癌和甲状腺癌,赛普替尼用于其他RET融合阳性实体瘤的研究正在如火如荼的开展中。尤其是在一些RET融合更为罕见的实体瘤中,如消化系统肿瘤,赛普替尼或将成为治疗罕见RET融合阳性的实体瘤“万能药”。

- 【非小细胞肺癌】SH-1028片[适 应 症]非小细胞肺癌[试验分期]Ⅲ期
- 【食管鳞癌】LY01015注射液联合氟尿嘧啶和顺铂[适 应 症]晚期或转移性食管鳞癌[试验分期]Ⅲ期
- 【黑色素瘤】GT101注射液[适 应 症]一线治疗失败的宫颈鳞癌或恶性黑色素瘤患者[试验分期]Ⅰ期
- 【实体瘤】注射用TFX05-01[适 应 症]本品拟用于经病理组织/细胞学或临床诊断确诊,不适合手术或局部治疗, 或经过手术和/或经末线标准治疗后疾病进展和/或无法耐受标准治疗的晚期恶性实体瘤患者。[试验分期]Ⅰ期
- 【实体瘤】BC007抗体注射液[适 应 症]CLDN18.2表达的晚期实体瘤[试验分期]Ⅰ期
- 【淋巴瘤】MIL62注射液联合来那度胺胶囊[适 应 症]难治的滤泡性淋巴瘤[试验分期]Ⅲ期