



适用于血液透析成人患者慢性肾病相关的中度至重度瘙痒
 德国费森尤斯卡比
德国费森尤斯卡比
本品适用于血液透析成人患者慢性肾病相关的中度至重度瘙痒。
本品仅限用于中心血液透析,在诊断和治疗本品适应症方面经验丰富的医疗保健专业人员使用,在开始使用本品治疗前,应排除慢性肾脏疾病以外导致瘙痒的原因。
(1)在血液透析治疗结束时或冲洗结束后,静脉推注本品进入透析回路的静脉管道,每周3次。
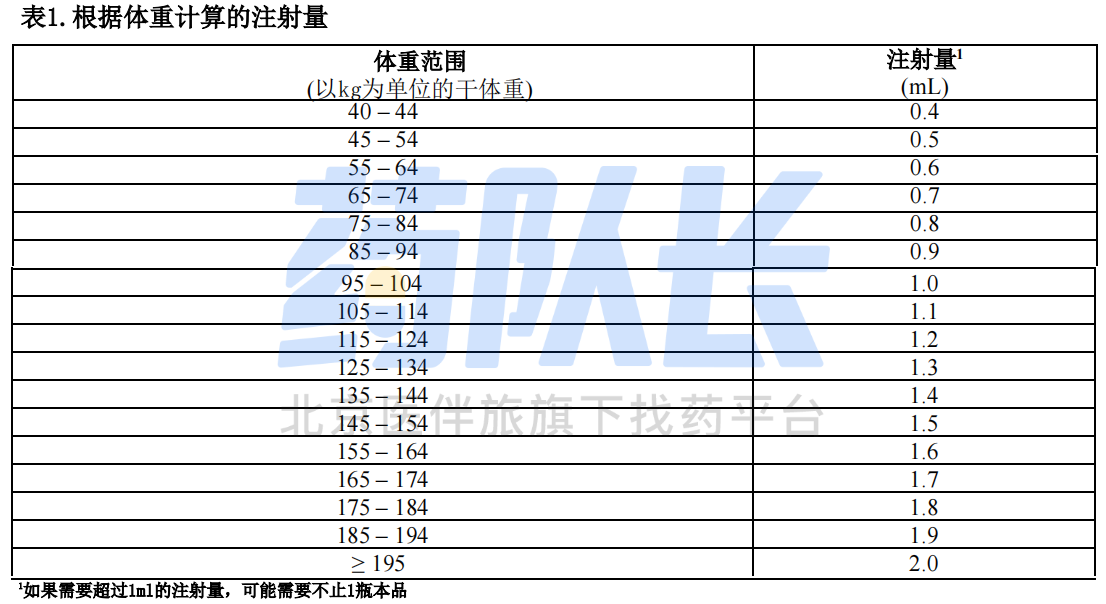
(2)本品的推荐剂量为干体重(即透析后目标体重)0.5mcg/kg,所需的总注射量(ml)计算如下:0.01×干体重(kg),四舍五入到最接近的十分之一的剂量(0.1ml);对于干体重≧195kg的患者,推荐剂量为100mcg(2ml),本品注射量详见下表1。
(3)预计在治疗2-3周后,本品在减少瘙痒方面会有效果。
如果错过了定期安排的血液透析治疗,应在下次血液透析治疗时予以相同剂量的本品。
如果在一周内进行了第4次血液透析治疗,应在血液透析结束时按推荐剂量给予本品,但即使一周内血液透析治疗次数超过4次,本品治疗也不应超过每周4次。因为既往治疗中剩余的大部分活性成分将通过血液透析清除,一周内的第4次本品治疗可能不会积累有效成分,反而可能会影响安全性。但由于数据不足,第四剂的安全性和有效性尚未完全明确。
(1)对于血液透析治疗时间少于1小时的患者,应暂停使用本品直至下次血液透析。
(2)在血液透析患者中给予本品后,高达70%本品的有效成分在下一次血液透析前从体内排出。在血液透析后1小时内,与下次血液透析时相比,血药浓度降低约40-50%。
轻度或中度肝功能损害患者不需要调整剂量,本品尚未在严重肝功能损害患者中进行研究[国家癌症研究所(NCI)器官功能障碍工作组(ODWG)],因此不建议在这类患者中使用。
老年患者的推荐剂量与成人患者相同。
本品在0-17岁儿童中的安全性和有效性尚未确定,暂无研究数据。
(1)本品不应稀释,不应与其他药品混合使用。
(2)本品可被透析器膜过滤,必须在血液不再通过透析器循环后给药。在血液透析治疗结束时,在冲洗期间或冲洗后,静脉推注本品进入透析回路的静脉管道,每周3次。
(3)当在冲洗后给药时,应在注射本品后予以至少10ml的9mg/ml(0.9%)的氯化钠注射液。如果剂量是在反冲洗期间给予的,则不需要再使用9mg/ml(0.9%)氯化钠注射液来冲洗管线。
如果用药过量,可增加剂量依赖性不良反应,应根据患者的临床状况提供适当的医疗护理。使用高通量透析器进行4小时的血液透析,可有效地从血浆中清除约70-80%本品,并且在两个透析周期的第二个周期结束时,血浆中未检测到本品。
本品最常见的不良反应为嗜睡、头晕、感觉异常(包括感觉减退、口腔感觉异常和口腔感觉减退)、头痛、恶心、呕吐、腹泻和精神状态改变(包括意识模糊状态),大多数为轻度或中度。
对本品活性成分或任何辅料过敏的患者禁用。
无需任何特殊储存条件。
成人,妊娠期禁用,哺乳期、儿童和老年患者在医生指导下用药。
1.尚未进行本品的临床相互作用研究。本品不抑制或诱导CYP450酶,不是CYP450酶的底物。既不是葡萄糖醛酸化酶的抑制剂,也不是人类转运蛋白的底物或抑制剂,因此本品不太可能与其他药物发生相互作用。
2.同时服用镇静性抗组胺药、阿片类镇痛药或其他中枢神经系统抑制剂(如可乐定、昂丹司琼、加巴喷丁、普瑞巴林、唑吡坦、阿普唑仑、舍曲林、曲唑酮),可能会增加头晕和嗜睡的风险。
24个月
注射剂
德国费森尤斯卡比
本品的活性成分为difelikefalin
本品为透明、无色,无颗粒的溶液(pH值4.5)
高钾血症经常发生在血液透析的慢性肾病患者中,建议经常监测钾水平。
尚未对纽约心脏协会IV级心力衰竭患者进行本品的研究。
本品是一种作用于外周的κ阿片受体激动剂,但对中枢神经系统(CNS)的作用具有限制性。血脑屏障(BBB)的完整性对于最大限度地减少中枢神经系统对本品的吸收至关重要。临床上血脑屏障破坏严重的患者,例如原发性脑恶性肿瘤、中枢神经系统转移或其他炎性疾病、活动期多发性硬化、晚期阿尔茨海默病,可能存在本品进入中枢神经系统的风险。此类患者应谨慎使用本品,需进行获益—风险评估,并观察潜在的中枢神经系统影响。
(1)接受本品治疗的患者曾出现头晕和嗜睡,持续治疗后可能会逐渐消退,应提醒患者谨慎驾驶或操作危险机器。
(2)联合使用镇静性抗组胺药、阿片类镇痛药或其他中枢神经系统抑制剂可能会增加这些不良反应的发生风险,因此在使用本品治疗时应谨慎。
此类药物每瓶钠含量少于1mmol,基本上不含钠。
(以上参考自欧洲药监局EMA药品说明书2022.07版)
1.如果您发现该药品信息有任何错误,请联系我们修改,我们将热忱感谢您的批评指正!
2.本站所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考!
