


1.适用于低CD4(﹤200 CD4 淋巴细胞/mm³)及有广泛皮肤黏膜内脏疾病的与艾滋病相关的卡波氏肉瘤病人。
2.一线全身化疗药物。
3.适用于治疗病情有进展的卡波氏肉瘤病人的二线化疗药物。
4.适用于不能耐受长春新碱、博莱霉素和多柔比星(或其他蒽环类抗生素)联合化疗的病人。
使用5%葡萄糖注射稀释后使用,静脉滴注30分钟以上。(注:根据推荐剂量和病人的体表面积确定剂量并按方法进行稀释,若剂量﹤90mg,使用250ml5%葡萄糖注射液稀释,若剂量≥90mg,使用500ml5%葡萄糖注射液稀释)
本品推荐剂量为20mg/㎡,每2-3周1次静脉内给药,两次给药时间不宜少于10天,持续给药2-3个月会产生疗效,为保持一定疗效,应在病人需要时给药。
1.禁用于肌肉和皮下注射,禁止未经稀释直接原液注射,不建议在输液管中接装过滤器。
2.禁止使用有沉淀物或其他杂质的器材。
3.由于本品中未加防腐剂或其他抑菌剂,故必须严格遵守无菌操作。
4.除5%葡萄糖注射液外的其他稀释剂或任何抑菌剂都可能使本品发生沉淀。
5.为减少滴注反应的风险,起始给药速率应不大于1mg/min,如果无滴注反应,以后的滴注可在60分钟内完成。
6.不应与其他药物混合使用。
表1.出现手足红肿综合征(PPE)剂量调整方案:
前次给予本品后周数 | |||
毒性级别 | 第4周 | 第5周 | 第6周 |
1级(轻度红斑、水肿或脱皮但不影响日常行为活动) | 继续给药:如病人之前曾发生过3.4级皮肤毒性反应,推迟1周给药 | 继续给药:如病人之前曾发生过3.4级皮肤毒性反应,推迟1周给药 | 减量25%继续给药,并恢复4周给药间隔 |
2级(红斑、脱皮或水肿,有影响但可以进行正常的活动,小水泡或溃疡﹤2cm) | 推迟1周给药 | 推迟1周给药 | 减量25%继续给药,并恢复4周给药间隔 |
3级(发热、溃疡或肿胀影响行走或正常行为,不能正常穿衣) | 推迟1周给药 | 推迟1周给药 | 停止治疗 |
4级(扩散或局部感染并发症,或卧床不起或住院) | 推迟1周给药 | 推迟1周给药 | 停止治疗 |
表2.出现口腔炎时剂量调整方案:
前次给予本品后周数 | |||
毒性级别 | 第4周 | 第5周 | 第6周 |
1级(无痛的溃疡、红斑或轻度疼痛) | 继续给药:如病人之前曾发生过3.4级口腔炎,推迟1周给药 | 继续给药:如病人之前曾发生过3.4级口腔炎,推迟1周给药 | 减量25%继续给药,并恢复4周给药间隔,或遵医嘱停止治疗 |
2级(疼痛性红斑、水肿或溃疡但可以进食) | 推迟1周给药 | 推迟1周给药 | 减量25%继续给药,并恢复4周给药间隔或遵医嘱进行治疗 |
3级(疼痛性红斑、水肿或溃疡不能进食) | 推迟1周给药 | 推迟1周给药 | 停止治疗 |
4级(需要接受肠道内或肠道外营养支持治疗) | 推迟1周给药 | 推迟1周给药 | 停止治疗 |
表3.出现血液毒性时的剂量调整:
毒性级别 | 中性粒细胞绝对计数(/mm³) | 血小板(/mm³) | 剂量调整 |
1级 | 1500-1900 | 75000-150000 | 继续治疗,无需剂量调整 |
2级 | 1000-﹤1500 | 50000-﹤75000 | 暂停治疗,直至中性粒细胞计数﹥1500和血小板﹥75000,可以原剂量给药 |
3级 | 500-999 | 25000-﹤50000 | 暂停治疗,直至中性粒细胞计数﹥1500和血小板﹥75000,可以原剂量给药 |
4级 | ﹤500 | ﹤25000 | 暂停治疗,直至中性粒细胞计数﹥1500和血小板﹥75000,降低剂量25%继续给药或继续原剂量给药但同时给予细胞因子支持治疗 |
最常见的不良反应是骨髓抑制,其他发生率较高的不良反应包括:恶心、乏力、脱发、发热、腹泻,与输注有关的急性反应和口腔炎等。
1.对本品活性成分或其他成分过敏的病人禁用。
2.孕妇和哺乳期妇女禁用。
3.使用α干扰素进行局部或全身治疗有效的AIDS-KS病人,禁用本品。
未开封的药瓶应保存在 2-8°C 环境下,避免冷冻。
成人
同时合用其他细胞毒性药物,特别是骨髓毒性药物时需谨慎。
24个月
注射剂
美国强生
本品主要成分为盐酸多柔比星,化学结构式为:
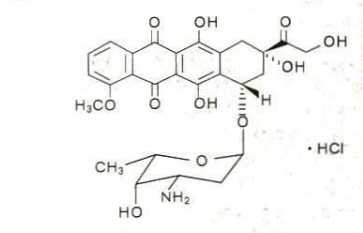
辅料为:氢化大豆磷脂酰胆碱、培化磷脂酰乙醇胺、胆固醇、蔗糖、组氨酸、盐酸。
本品为红色半透明的混悬液。
1.所有接受本品治疗的患者均需经常进行心电图监测。
2.使用本品治疗期间需经常检查血细胞计数。
3.需操作机器或驾车行驶的患者谨慎使用本品。
4.建议孕龄妇女或其配偶在治疗期间及停药后6个月内避孕。
(以上内容参考自中文版说明书2021.06版)
1.如果您发现该药品信息有任何错误,请联系我们修改,我们将热忱感谢您的批评指正!
2.本站所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考!
