

本品联合曲美替尼适用于治疗 BRAF V600 突变阳性的不可切除或转移性黑色素瘤患者
(1)本品联合曲美替尼治疗前,须通过国家药监局批准的检测方法进行 BRAF V600 突变检测,确认为 BRAF V600 突变阳性的患者方可接受本品治疗
(2)本品联合曲美替尼不适用于 BRAF 野生型黑色素瘤患者
(1)本品的推荐剂量为 150 mg 每日两次(相当于 300 mg 每日总剂量)
(2)本品需联合曲美替尼治疗,直至出现疾病进展或不可耐受的毒性反应
(3)本品应在餐前至少 1 小时前或餐后至少 2 小时后服用,给药间隔约 12 小时
(4)应在每天相同时间服用本品。 如果漏服一剂计划剂量的本品,且距下一次服药时间不足 6 小时,则不应补服,下次按原间隔时间服药
(5)当本品联合应用曲美替尼时,应在每天相同时间服用曲美替尼每日一次,与在早晨或晚上给药的本品一起服用
(6)请勿打开、压碎或打破本品
(1)对于皮肤鳞状细胞癌(cuSCC)或新的原发性黑色素瘤不良反应,不建议进行剂量调整或暂停,在给予本品联合应用曲美替尼治疗时,如果出现治疗相关的毒性,则两种治疗药物应同时进行剂量减少、中断或停止
(2)对于主要与甲磺酸达拉非尼相关的不良反应(葡萄膜炎、非皮肤恶性 肿瘤),以及主要与曲美替尼相关的不良反应(视网膜静脉阻塞(RVO)、视网膜色素上皮脱 离(RPED)、间质性肺病(ILD)/肺炎和单纯性静脉血栓栓塞),仅需对其中一种治疗进行剂量调整
表 1 针对不良反应推荐的甲磺酸达拉非尼剂量减少方法
| 措施 | 剂量调整 |
| 第一次剂量减少 | 口服 100 mg,每日两次 |
| 第二次剂量减少 | 口服 75 mg,每日两次 |
| 第三次剂量减少 | 口服 50 mg,每日两次 |
| 后续剂量调整 | 如果口服本品 50 mg 每日两次仍不能耐受,则永久停药 |
表2 针对不良反应甲磺酸达拉非尼剂量调整方法
| 不良反应的严重程度 | 甲磺酸达拉非尼剂量调整 |
| 新的原发性恶性肿瘤 | |
| 非皮肤 RAS 突变阳性恶性肿瘤 | 永久停用本品 |
| 心肌病 | |
症状性充血性心力衰竭 LVEF 较基线绝对降低>20%,低于 LLN | 暂停本品,直至 LVEF 至少改善至机构 LLN 且较基线绝对降低≤10%,则以相同剂量恢复应用 |
| 葡萄膜炎 | |
| 葡萄膜炎,包括虹膜炎和虹膜睫状体炎 | 针对使用眼部治疗无缓解的轻度或中度葡萄膜 炎,或重度葡萄膜炎,暂停本品 6 周 如果改善至 0-1 级,则以相同或较低剂量水平 恢复应用 如未改善,则永久停药 |
| 发热反应 | |
| 发热至 38.5°C - 40°C | 暂停本品,直至退热,然后以相同或较低剂量水 平恢复应用 |
发热高于 40°C 发热伴有发冷、低血压、脱水或肾功能衰竭 | 暂停本品,直至退热,然后以较低剂量水平恢 复应用或永久停用本品 |
| 皮肤毒性 | |
不能耐受的 2 级 3 或 4 级 | 暂停本品 3 周 如有改善,则以较低剂量水平恢复应用 如未改善,则永久停药 |
| 其他不良反应,包括出血 | |
不能耐受的 2 级 任何 3 级 | 暂停本品 如果改善至 0-1 级,则以较低剂量水平恢复应 用 如未改善,则永久停药 |
| 首次出现的任何4 级 | 暂停本品,直至不良反应改善至 0-1 级,然后 以较低剂量水平恢复应用或永久停用本品 |
| 经常出现的 4 级 | 永久停用本品 |
接受曲美替尼与Tafinlar联用参加者报道的最常见副作用包括发热,畏寒,疲倦,皮疹,恶心,呕吐,腹泻,腹痛,外周性水肿(手和足肿胀),咳嗽,头痛,关节痛,夜汗,食欲减低,便秘和肌肉痛。临床试验期间,当曲美替尼与Tafinlar联合使用发热的发生率和严重程度增加。
严重副作用包括出血,凝块形成,心衰,皮肤问题和眼问题。Tafinlar的严重副作用之一—皮肤新鳞状细胞癌的发展—当药物与曲美替尼联合使用时减少;这与这些两个药物在靶向分子通路的作用一致。
(1)对达拉非尼作为单药最常见不良反应(≥20%)是角化过度,头痛,发热,关节炎,乳头状瘤,脱发,和掌跖红肿疼痛综合征。
(2)达拉非尼与曲美替尼联用最常见不良反应(≥20%)包括发热,畏寒,疲乏,皮疹,恶心,呕吐,腹泻,腹痛,外周性水肿,咳嗽,头痛,关节痛,夜汗,食欲减低,便秘,和肌痛。
遮光,密闭,干燥处
成人患者
(1)不建议同时给予CYP3A4或CYP2C8的强抑制剂。
(2)不建议同时给予强CYP3A4或CYP2C8诱导剂。
(3)增加胃pH药物可能减低dabrafenib浓度。
(4)与药物是CYP3A4,CYP2C8,CYP2C9,CYP2C19,或CYP2B6的敏感底物同时使用可能导致这些药物疗效丧失。
24个月
胶囊剂
瑞士诺华
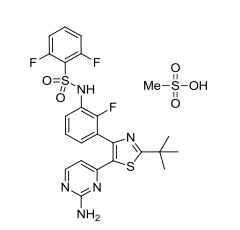
本品活性成份为甲磺酸达拉非尼
化学结构式为:
本品为深粉色胶囊,印有“GS LHF 75mg”,内容物为白色或类白色粉末。
新原发性皮肤恶性病:开始治疗前,用治疗时每3个月和终止TAFINLAR后直至6个月进行皮肤学评价。
在BRAF野生型黑色素瘤中促肿瘤:用BRAF抑制剂可能发生细胞增殖增加。
严重发热性药物反应:不用TAFINLAR如发热≥101.3°F或发生并发发热。
高血糖:预先存在糖尿病或高血糖患者中监视血清糖水平。
葡萄膜炎和虹膜炎:常规监视患者视力症状。
葡萄糖-6磷酸脱氢酶缺乏:严密监视溶血性贫血。
胚胎胎儿毒性:可能致胎儿危害。忠告生殖潜力女性对胎儿潜在风险。TAFINLAR可能使激素避孕药疗效较低和应使用另外避孕方法。
1.如果您发现该药品信息有任何错误,请联系我们修改,我们将热忱感谢您的批评指正!
2.本站所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考!
