



适用于在化疗期间或之后出现疾病进展的复发性或转移性宫颈癌成年患者的治疗
根据肿瘤缓解率和缓解持续性,该适应症获得加速批准,该适应症的继续批准可能取决于在确认性试验中对临床益处的验证和描述
Tivdak的推荐剂量为2mg/kg(对于≥100kg的患者,最大剂量为200mg),每3周静脉输注30分钟,直至疾病出现进展或出现不可接受的毒性
遵循以下建议以降低眼部不良反应的风险:
1、眼科检查:在基线、每次剂量前和临床需要时进行眼科检查,包括视力和裂隙灯检查
2、局部皮质类固醇滴眼液:初始处方和所有皮质类固醇药物的更新都应在使用裂隙灯检查后进行;在每次注射前,先滴入每只眼睛;指导患者在每次注射后72小时继续按规定给每只眼滴眼药水
3、局部眼部血管收缩滴剂:每次输注前立即在每只眼睛中给药
4、冰袋:在输注Tivdak时使用冷却眼罩
5、局部润滑眼药水:指导患者在治疗期间和最后一剂Tivdak后30天内使用
6、隐形眼镜:建议患者避免佩戴隐形眼镜,除非他们的眼部护理提供者建议在整个治疗期间佩戴隐形眼镜
表1 剂量调整方案
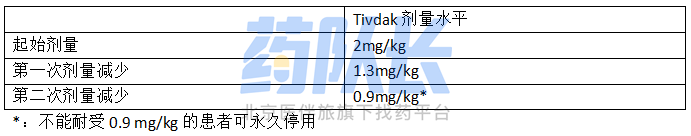
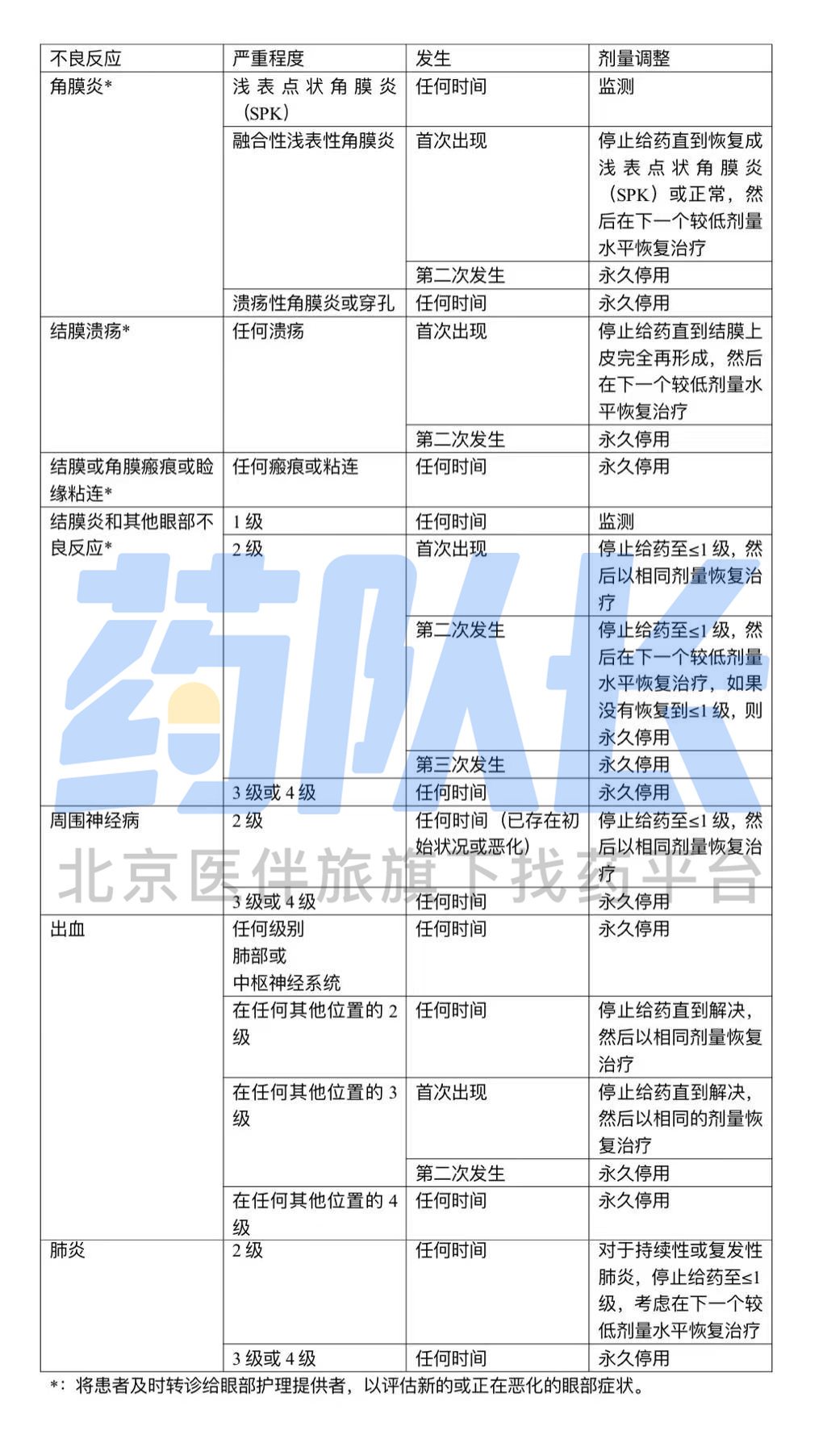
表2 针对不良反应的剂量调整
1、仅将Tivdak作为静脉输注给药
2、Tivdak是一种危险的药物,遵循适用的特殊处理和处置程序
3、不要混合Tivdak作为静脉推注或推注
4、不要将Tivdak与其他药物混合,或作为输液给药
使用适当的无菌技术来复溶和配制给药溶液,给药前,Tivdak小瓶用注射无菌用水(USP)复溶,随后在含有下列物质之一的静脉输液袋中稀释重建的溶液:5%葡萄糖注射液、0.9%氯化钠注射液或乳酸林格注射液
1、根据患者的体重计算推荐剂量,以确定所需的药瓶数量
2、用4ml无菌注射用水(美国药典)复溶每个40mg小瓶,得到10mg/ml Tivdak
3、缓慢旋转每个小瓶,直到内容物完全溶解,让复溶的小瓶沉淀,不要摇动小瓶,不要暴露在阳光直射下
4、只要溶液和容器允许,注射用药品在给药前应目视检查是否有颗粒物质和变色;重新配制的溶液应呈现澄清至微乳白色,无色至棕黄色,且无可见颗粒;丢弃任何有可见颗粒或变色的小瓶
5、根据计算出的剂量,小瓶中的复原溶液应立即加入到输液袋中;本产品不含防腐剂,如果不立即使用,在稀释前,复溶样品瓶可在2°C-8°C的冷藏条件下储存长达24小时,或在高达25°C的室温下储存最多8小时;不要冻结,不要暴露在阳光直射下,丢弃未使用的装有超过建议储存时间的复溶溶液的小瓶
1、从小瓶中取出计算剂量的复溶溶液,并转移到输液袋中
2、用下列物质之一稀释:5%葡萄糖注射液,0.9%氯化钠注射液或乳酸林格注射液;输液袋的大小应允许有足够的稀释剂,以达到0.7mg/ml-2.4mg/ml Tivdak的最终浓度
3、轻轻倒置混合稀释溶液,不要摇晃袋子,不要暴露在阳光直射下
4、使用前,目视检查输液袋是否有任何颗粒物质或变色,重新配制的溶液应呈现澄清至微乳白色,无色至棕黄色,且无可见颗粒;丢弃任何有可见颗粒或变色的小瓶
5、丢弃单剂量瓶中剩余的任何未使用部分
1、确认类固醇和血管收缩剂滴眼液的给药
2、使用血管收缩眼药水后,将冷敷包完全敷在眼睛上,并在输液过程中保持不动;在整个输液过程中,根据需要更换冰袋,以确保眼部区域保持凉爽
3、在30分钟内,立即通过含有0.2μm在线过滤器的静脉注射管进行输液
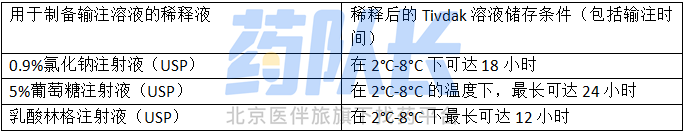
4、如果不立即输注,按照表3的规定将稀释的Tivdak溶液冷藏保存;如果储存时间超过这些限制,则丢弃;不要冻结;从冰箱中取出后,在4小时内(包括输注时间)完成稀释的Tivdak输注液的给药
表 3 稀释的Tivdak溶液冷藏储藏条件
最常见的(≥25%)不良反应(包括实验室异常)包括血红蛋白减少、疲劳、淋巴细胞减少、恶心、周围神经病变、脱发、鼻出血、结膜不良反应、出血、白细胞减少、肌酐增加、干眼、凝血酶原国际标准化比率增加、活化部分凝血活酶时间延长、腹泻和皮疹
尚不明确
储存在20°C-25°C下;允许偏差为15°C-30°C
成人患者
MMAE是CYP3A4底物,Tivdak与CYP3A4强抑制剂合用可能会增加非结合MMAE的暴露量,从而增加Tivdak不良反应的风险,密切监测Tivdak与强CYP3A4抑制剂同时使用时患者的不良反应
36个月
冻干粉
美国seagen
本品是一种组织因子导向的抗体药物缀合物,
化学结构式为: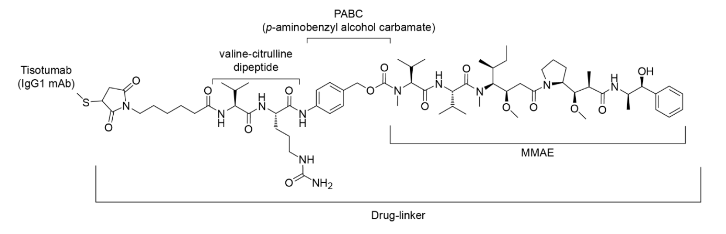
注射用:40mg本品为白色至灰白色冻饼或粉末,装于单剂量小瓶,用于复溶。
(1)临床试验中,使用本品后有出现眼部不良反应的报道,因此将患者转介给眼科护理提供者进行眼科检查,包括在基线、每次剂量前和临床需要时的视力和裂隙灯检查,坚持用药前和必要的眼部护理,以减少眼部不良反应的风险;对于任何新的或恶化的眼部体征和症状,及时将患者转介给眼科护理提供者
(2)根据不良反应的严重程度,暂停、减少剂量或永久停用本品
监测患者的神经病变体征和症状,如感觉异常、刺痛或烧灼感、神经性疼痛、肌肉无力或感觉异常;对于出现新的或恶化的外周神经病变的患者,根据外周神经病变的严重程度,暂停给药,然后减少剂量或永久停用Tivdak
(1)监测患者有无出血的体征和症状,对于出现肺部或中枢神经系统出血的患者,应永久停用Tivdak
(2)对于任何其他部位的≥2级出血,应暂停治疗,直到出血消退,血红蛋白稳定,没有可能增加继续治疗风险的出血因素,也没有可能增加出血复发风险的解剖或病理条件
(3)解决后,恢复治疗或永久停用Tivdak
监测患者是否出现肺炎的肺部症状;在放射学检查中,症状可能包括缺氧、咳嗽、呼吸困难或间质浸润,应通过适当的调查排除此类症状的传染性、肿瘤性和其他原因
对于出现持续性或复发性2级肺炎的患者,停止使用Tivdak,并考虑减少剂量;对所有3级或4级肺炎患者永久停用Tivdak
告知患者对胎儿的潜在风险,建议具有生殖潜力的女性在接受Tivdak治疗期间以及最后一次给药后的2个月内使用有效的避孕措施;建议具有生殖潜力的女性伴侣的男性患者在使用 Tivdak治疗期间以及最后一次给药后的4个月内使用有效的避孕方法
(以上内容参考自美国FDATivdak说明书2021.09版)
1.如果您发现该药品信息有任何错误,请联系我们修改,我们将热忱感谢您的批评指正!
2.本站所表达的任何关于疾病的建议都不应该被视为医生的建议或替代品,请咨询您的治疗医生了解更多细节。本站信息仅供参考!
